Bộ Y tế công bố 46 công ty dược nước ngoài phải kiểm soát chặt nhập khẩu
Các doanh nghiệp này buộc phải kiểm tra 100% trước khi lưu hành tại Việt Nam. Danh sách bao gồm nhiều đơn vị từ Ấn Độ, Mỹ và Hàn Quốc có lịch sử vi phạm chưa khắc phục.
Siết chặt chất lượng thuốc nhập khẩu
Trong đợt công bố mới nhất (Đợt 42), Cục Quản lý Dược đã chỉ mặt đặt tên 46 cơ sở sản xuất thuốc nước ngoài có thuốc vi phạm chất lượng. Theo đó, toàn bộ các lô thuốc nhập khẩu từ các doanh nghiệp này sẽ phải trải qua quy trình lấy mẫu kiểm tra chất lượng nghiêm ngặt trước khi được phép lưu hành tại Việt Nam.
 |
| Cơ quan quản lý nhấn mạnh, việc rà soát được thực hiện định kỳ dựa trên kết quả giám sát chất lượng thuốc lưu hành và đánh giá mức độ khắc phục hậu quả của nhà sản xuất. |
Quyết định này được thực hiện dựa trên quy định tại Điều 9 Thông tư số 30/2025/TT-BYT (ngày 01/07/2025) của Bộ Y tế. Cơ quan quản lý nhấn mạnh, việc rà soát được thực hiện định kỳ dựa trên kết quả giám sát chất lượng thuốc lưu hành và đánh giá mức độ khắc phục hậu quả của nhà sản xuất. Đây là biện pháp kỹ thuật quan trọng nhằm thiết lập "hàng rào" bảo vệ an toàn cho người bệnh, trong bối cảnh Việt Nam đang nhập khẩu lượng lớn thuốc thành phẩm và nguyên liệu.
Ấn Độ chiếm đa số, nhiều "ông lớn" có lịch sử vi phạm dày đặc
Trong danh sách 46 doanh nghiệp bị "tuýt còi", Ấn Độ tiếp tục là quốc gia có số lượng công ty vi phạm nhiều nhất. Nhiều cái tên đã bị đưa vào diện tiền kiểm từ giai đoạn 2013-2015 nhưng đến nay vẫn chưa đủ điều kiện để rút khỏi danh sách.
Cụ thể, các doanh nghiệp như ACI Pharma, All Serve Healthcare, Altomega Drugs, Chemfar Organics, Elegant Drugs, Euro Healthcare, Fine Pharmachem hay Mediwin Pharmaceuticals đều có thời gian vi phạm kéo dài.
Nghiêm trọng hơn, một số nhà sản xuất vi phạm ở cả hai khâu tiền kiểm và hậu kiểm, điển hình là AMN Life Science, Medico Remedies, Minimed Laboratories và Marksans Pharma. Đặc biệt, công ty Syncom Formulations (Ấn Độ) được xem là ví dụ điển hình cho sự chây ỳ khắc phục với hồ sơ ghi nhận tới 12 lần vi phạm.
Không chỉ tập trung ở các quốc gia đang phát triển, danh sách "đen" lần này còn có sự góp mặt của các doanh nghiệp đến từ các thị trường có tiêu chuẩn dược phẩm khắt khe như Mỹ, Hàn Quốc, Ý.
Một số công ty Mỹ như ADH Health Products hay Robinson Pharma cũng bị liệt kê, cho thấy các vi phạm về chất lượng thuốc có thể xảy ra ở bất kỳ nền sản xuất nào. Ngoài ra, các doanh nghiệp từ Bangladesh, Trung Quốc, Indonesia, Pakistan, Romania cũng nằm trong diện giám sát.
Các đơn vị như Reman Drug Laboratories, CSPC Zhongnuo, PT. Merck Tbk, Crown Pharm hay Yuyu Inc. dù bị công bố vi phạm từ rất sớm nhưng vẫn chưa đáp ứng được các tiêu chí khắt khe để được gỡ bỏ biện pháp tiền kiểm.
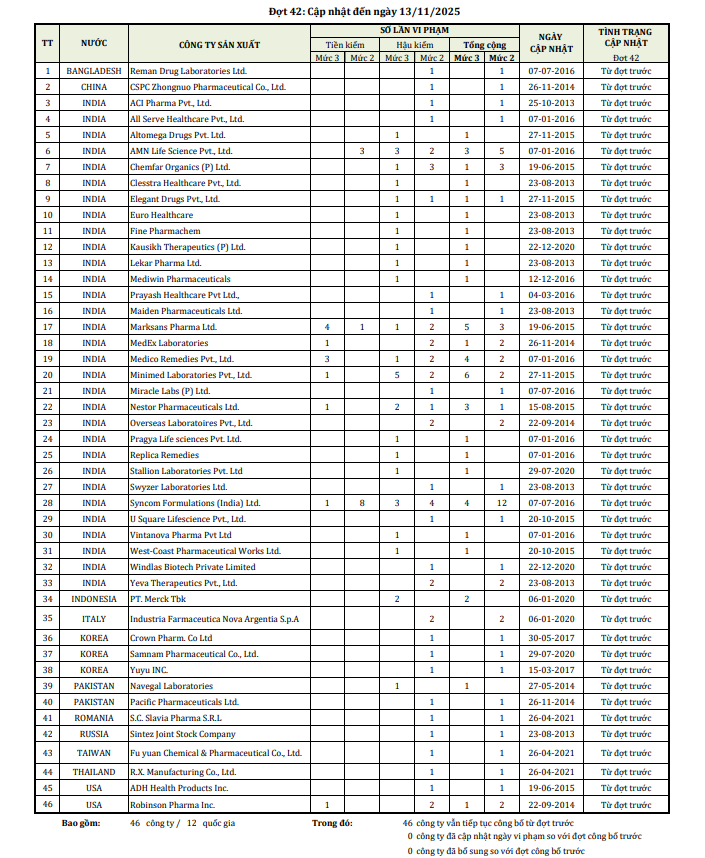 |
| Danh sách công bố các CSSX thuốc nước ngoài có thuốc vi phạm chất lượng. |
Chỉ duy nhất một doanh nghiệp được "minh oan"
Điểm sáng hiếm hoi trong đợt cập nhật này là trường hợp của công ty Zee Laboratories (Ấn Độ). Đây là doanh nghiệp duy nhất được Cục Quản lý Dược rút tên khỏi danh sách giám sát.
Lý do được đưa ra là Zee Laboratories đã hoàn thành việc lấy mẫu kiểm tra chất lượng 100% lô thuốc nhập khẩu mà không phát hiện vi phạm nào, đáp ứng đầy đủ yêu cầu tại Khoản 2 Điều 9 Thông tư 30/2025/TT-BYT.
Theo quy định, để được "thoát án" tiền kiểm, doanh nghiệp phải chịu sự giám sát trong 6-12 tháng và chứng minh được sự cải thiện chất lượng thông qua việc không phát sinh vi phạm mới trong tất cả các lô hàng nhập khẩu. Việc 46 công ty vẫn bị giữ lại trong danh sách cho thấy nỗ lực cải thiện chất lượng của phần lớn các đơn vị này chưa đạt yêu cầu.
Trước tình hình trên, Cục Quản lý Dược đã đề nghị Sở Y tế các tỉnh, thành phố và y tế các ngành chỉ đạo bộ phận chuyên môn tăng cường giám sát việc chấp hành quy định kiểm tra chất lượng thuốc nhập khẩu. Đồng thời, các đơn vị cần xử lý nghiêm các tổ chức, cá nhân vi phạm theo quy định hiện hành.
Việc công khai danh sách này giúp hệ thống khám chữa bệnh và các đơn vị nhập khẩu nắm rõ thông tin, từ đó chủ động hơn trong việc lựa chọn nguồn cung ứng thuốc, hạn chế tối đa nguy cơ thuốc kém chất lượng đến tay người bệnh.