Thu hồi thuốc Rabesta 20 và thuốc PQA Sinh khí kém chất lượng
Sở Y tế Hà Nội mới đây đã ra quyết định thu hồi thuốc PQA Sinh khí và thuốc Rabesta 20 do không đảm bảo tiêu chuẩn chất lượng.
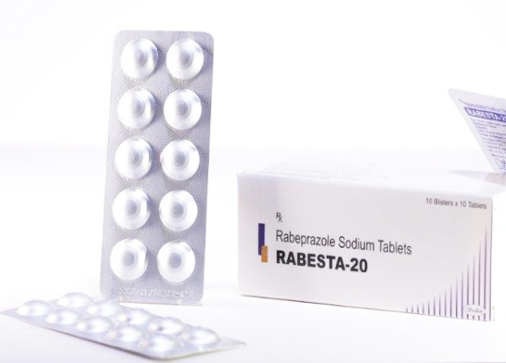 |
| Thuốc Rabesta 20 |
Tại Văn bản số 3365/SYT-NVD Sở Y tế Hà Nội cũng quyết định thu hồi thuốc Rabesta 20 do Công ty Stallion Laboratories Pvt.Ltd (Ấn Độ) sản xuất, Công ty CP Dược thiết bị y tế Đà Nẵng nhập khẩu do không đạt yêu cầu chất lượng về chỉ tiêu độ an toàn.
Theo đó, Sở Y tế thông báo thu hồi viên nén bao tan trong ruột Rabesta 20 (Rabeprazol natri 20mg), SĐK: VN 18521-12, Lô SX: V-159, NSX: 14/02/2022, HD 13/02/2024.
Sở Y tế Hà Nội yêu cầu giám đốc Công ty TNHH Thương Mại Dược phẩm Huy Khánh phải thực hiện thu hồi triệt để lô thuốc không đạt tiêu chuẩn chất trên nêu trên.
Sở Y tế sẽ kiểm tra, giám sát việc thu hồi thuốc viên nén bao tan trong ruột Rabesta 20 (Rabeprazol natri 20mg) SĐK: VN- 18521, Lô SX: V-159. HD 13/02/2024 của các đơn vị.
Sở Y tế yêu cầu các cơ sở y tế công lập trực thuộc ngành, các cơ sở y tế ngoài công lập, các doanh nghiệp kinh doanh thuốc, các cơ sở bán lẻ thuốc trên địa bàn khẩn trương rà soát, thu hồi lô thuốc không đạt tiêu chuẩn chất lượng.
Phòng Y tế các quận, huyện, thị xã thông báo đến các cơ sở hành nghề trên địa bàn quản lý; tiến hành kiểm tra, giám sát việc thực hiện thu hồi của các cơ sở.
Thuốc Rabesta-20 được chỉ định sử dụng cho người trưởng thành với tác dụng điều trị bệnh trào ngược dạ dày thực quản gây viêm loét.
 |
| Thuốc PQA do Công ty cổ phần Dược phẩm PQA sản xuất bị thu hồi do không đạt tiêu chuẩn chất lượng. |
Tương tự, tại văn bản 3366/SYT-NVD của Sở Y tế Hà Nội về việc thu hồi thuốc PQA Sinh khí nêu rõ, thực hiện Công văn số 830/YDCT-QLD ngày 26/7 của Cục Quản lý Y dược cổ truyền về việc xử lý thuốc PQA Sinh khí không đạt tiêu chuẩn chất lượng.
Theo đó, Sở Y tế thông báo thu hồi trên địa bàn Hà Nội thuốc PQA Sinh khí, SĐK: VĐ-32300-19, lô SX: 140121, NSX 14/01/2021, HD 14/01/2024 do Công ty Cổ phần dược phẩm PQA sản xuất.
Thuốc PQA Sinh khí bị thu hồi là do thuốc không đạt yêu cầu chất lượng về chỉ tiêu Định tính Bạch Truật, Đương Quy (vi phạm mức độ 2).
Sở Y tế Hà Nội yêu cầu giám đốc Công ty ty TNHH Dược phẩm và Thương mại Đức Hà phải thực hiện thu hồi triệt để lô thuốc không đạt tiêu chuẩn chất lượng nêu trên, gửi thông báo thu hồi, hồ sơ thu hồi theo quy định.
Sở Y tế sẽ kiểm tra, giám sát việc thu hồi thuốc PQA Sinh khí. Các cơ sở y tế công lập trực thuộc ngành, các cơ sở y tế ngoài công lập, các doanh nghiệp kinh doanh thuốc, các cơ sở bán lẻ thuốc trên địa bàn khẩn trương rà soát, thu hồi lô thuốc không đạt tiêu chuẩn chất lượng nêu trên.
Phòng Y tế các quận, huyện, thị xã thông báo đến các cơ sở hành nghề trên địa bàn quản lý, tiến hành kiểm tra, giám sát việc thực hiện thu hồi của cơ sở.
Trung tâm Kiểm soát bệnh tật TP. Hà Nội đăng thông tin và phối hợp với các cơ quan truyền thông. Thông tin tới các cơ sở kinh doanh, sử dụng thuốc và người dân biết để không buôn bán, sử dụng.
Theo tìm hiểu được biết PQA Sinh Khí là một loại thuốc được các chuyên gia nghiên cứu dựa trên thành phần chính từ thảo mộc tự nhiên. Thuốc PQA Sinh khí có tác dụng điều trị hoa mắt, ù tai, kinh nguyệt không đều, giải nhiệt, lợi tiểu tiện, thanh phế, bổ trung ích khí,…
|
Thông tư 11/2018/TT-BYT về chất lượng thuốc và nguyên liệu làm thuốc Căn cứ Điều 4, Điều 5 Thông tư 11/2018/TT-BYT thì cơ sở kinh doanh dược, cơ sở pha chế thuốc áp dụng tiêu chuẩn chất lượng của thuốc, nguyên liệu làm thuốc theo dược điển hoặc theo tiêu chuẩn cơ sở đối với thuốc, nguyên liệu làm thuốc do cơ sở sản xuất, pha chế. Cơ sở kinh doanh dược, cơ sở pha chế thuốc phải tiến hành thẩm định, đánh giá phương pháp kiểm nghiệm ghi trong tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc do cơ sở sản xuất công bố áp dụng. Việc thẩm định phương pháp kiểm nghiệm thực hiện theo hướng dẫn về thẩm định quy trình phân tích của Hiệp hội các nước Đông Nam Á hoặc ICH được quy định tại Thông tư quy định việc đăng ký thuốc, nguyên liệu làm thuốc do Bộ trưởng Bộ Y tế ban hành. Bộ Y tế tổ chức thẩm định hồ sơ và phê duyệt tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc theo quy định về đăng ký thuốc, nguyên liệu làm thuốc, quy định về cấp phép nhập khẩu thuốc, nguyên liệu thuốc chưa có giấy đăng ký lưu hành. * Áp dụng dược điển: - Áp dụng Dược điển Việt Nam, dược điển tham chiếu: + Cơ sở kinh doanh dược, cơ sở pha chế thuốc được áp dụng Dược điển Việt Nam hoặc một trong các dược điển tham chiếu sau đây: Dược điển Châu Âu, Anh, Hoa Kỳ, Quốc tế, Nhật Bản; + Việc áp dụng tiêu chuẩn trong các dược điển quy định tại Điểm a Khoản này phải bao gồm toàn bộ các quy định về chỉ tiêu chất lượng, mức chất lượng và phương pháp kiểm nghiệm quy định tại chuyên luận thuốc, nguyên liệu làm thuốc tương ứng của dược điển áp dụng; bao gồm cả quy định về chỉ tiêu chất lượng, mức chất lượng và phương pháp kiểm nghiệm chung được quy định tại Phụ lục của dược điển; + Trường hợp cơ sở sản xuất công bố áp dụng một trong các dược điển quy định tại Điểm a Khoản này nhưng sử dụng phương pháp kiểm nghiệm khác với phương pháp kiểm nghiệm được ghi trong chuyên luận riêng của thuốc, nguyên liệu làm thuốc trong dược điển đã chọn thì phải chứng minh sự tương đương giữa phương pháp kiểm nghiệm của nhà sản xuất với phương pháp kiểm nghiệm được ghi trong dược điển. Kết quả kiểm nghiệm sử dụng phương pháp kiểm nghiệm ghi trong dược điển là căn cứ để kết luận chất lượng thuốc; + Đối với thuốc dược liệu, cơ sở kinh doanh dược, cơ sở pha chế thuốc được áp dụng dược điển quy định tại Điểm a Khoản này hoặc dược điển nước xuất xứ của thuốc. - Áp dụng dược điển nước ngoài khác với các trường hợp quy định tại Điểm a Khoản 1 Điều này: + Trường hợp cơ sở kinh doanh dược, cơ sở pha chế thuốc áp dụng dược điển nước ngoài khác dược điển tham chiếu quy định tại Điểm a Khoản 1 Điều này, tiêu chuẩn chất lượng áp dụng tối thiểu phải đáp ứng các yêu cầu sau: + Đáp ứng yêu cầu về chỉ tiêu chất lượng và mức chất lượng được quy định tại chuyên luận tiêu chuẩn chất lượng tương ứng của Dược điển Việt Nam hoặc một trong các dược điển tham chiếu; + Phương pháp kiểm nghiệm chung được áp dụng phải phù hợp với phương pháp kiểm nghiệm chung tương ứng được ghi tại Dược điển Việt Nam hoặc một trong các dược điển tham chiếu quy định tại Điểm a Khoản 1 Điều này. * Áp dụng tiêu chuẩn cơ sở: - Tiêu chuẩn cơ sở về thuốc, nguyên liệu làm thuốc phải đáp ứng quy định tại Điểm b Khoản 2 Điều 102 của Luật dược, cụ thể như sau: + Đáp ứng yêu cầu về chỉ tiêu chất lượng, mức chất lượng được quy định tại chuyên luận tương ứng của Dược điển Việt Nam và chỉ tiêu chất lượng, mức chất lượng, phương pháp kiểm nghiệm chung được quy định tại các Phụ lục của Dược điển Việt Nam; + Trường hợp Dược điển Việt Nam, dược điển tham chiếu quy định tại Điểm a Khoản 1 Điều 4 Thông tư này chưa có chuyên luận thuốc, nguyên liệu làm thuốc tương ứng, cơ sở xây dựng tiêu chuẩn trên cơ sở kết quả nghiên cứu khoa học (bao gồm cả kết quả nghiên cứu phát triển sản phẩm) hoặc theo quy định của dược điển nước ngoài khác. - Tiêu chuẩn cơ sở của thuốc pha chế, bào chế tại cơ sở khám bệnh, chữa bệnh do cơ sở xây dựng, đánh giá sự phù hợp và được người đứng đầu cơ sở ban hành. |